Blood Direct PCR-kit
Functies
■ Eenvoudig en snel: PCR-amplificatie kan direct worden uitgevoerd met bloed als sjabloon, zonder de vervelende stappen van monstervoorbereiding en DNA-extractie.
■ Hoge zuiverheid: het overslaan van monstervoorbehandeling en DNA-extractiestappen kan kruisbesmetting van monsters helpen voorkomen.
■ Hoge doorvoer: de PCR-identificatie voor grootschalige monsters kan worden uitgevoerd door de kit te combineren met PCR-platen met 96/384 putjes.
■ Sterke universaliteit: deze kit kan fragmenten met een hoge GC of fragmenten met een complexe secundaire structuur efficiënt amplificeren, en de amplificatielengte kan tot 5 kb zijn.
■ Sterke stressbestendigheid: deze kit kan worden toegepast voor verschillende soorten en bloedmonsters die op verschillende manieren worden geconserveerd.
Toepassingen
De PCR-producten van deze kit bevatten "A" aan het 3'-uiteinde, dat direct kan worden gebruikt voor het klonen van TA-vectoren. Deze kit kan worden gebruikt voor de amplificatie van genomische DNA-fragmenten, genetische analyse met hoge doorvoer en analyse van genotypering (zoals gendetectie).
Alle producten kunnen worden aangepast voor ODM/OEM. Voor details,klik op Aangepaste Service (ODM/OEM)
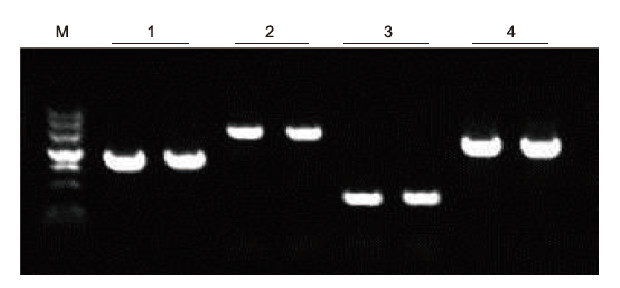 |
Met behulp van menselijke EDTA-anticoagulatie als sjabloon werden 4 genen met verschillende GC-inhoud geamplificeerd door Blood Direct PCR Kit. Het PCR-reactiesysteem was 20 l en 1 l bloed werd als sjabloon gebruikt. M: TIANGEN Marker II; 1: Fragmentgrootte 1090 bp, GC-gehalte 68,1%; 2: Fragmentgrootte 1915 bp, GC-gehalte 70,4%; 3: Fragmentgrootte 448 bp, GC-gehalte 74,8%; 4: Fragmentgrootte 1527 bp, GC-gehalte 61,5%. Experimentele resultaten: Blood Direct PCR Kit kan DNA-fragmenten effectief amplificeren met een GC-gehalte van 61,5%-74,8%, wat suggereert dat het in staat is om high-GC-fragmenten te amplificeren. |
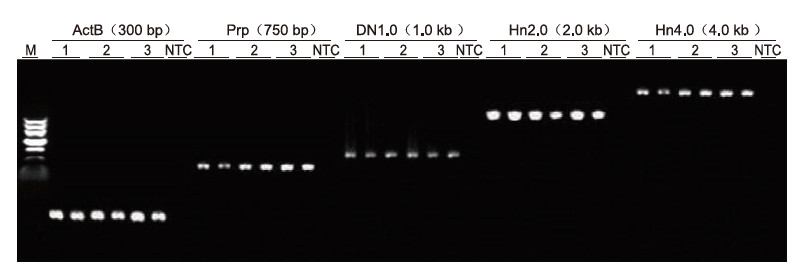 |
Met behulp van menselijke EDTA-anticoagulatie als matrijs werden 5 genen met verschillende lengtes (ActB, Prp, DN1.0, Hn2.0 en Hn4.0) geamplificeerd door Blood Direct PCR Kit. Het PCR-reactiesysteem was 20 l en 1 l bloed werd als sjabloon gebruikt. M: TIANGEN Marker II; 1-3: 3 verschillende bloedmonsters; NTC: controle zonder primers. Experimentele resultaten: Blood Direct PCR Kit kan fragmenten met een lengte van wel 4 kb amplificeren, wat suggereert dat het in staat is om lange fragmenten te amplificeren. |
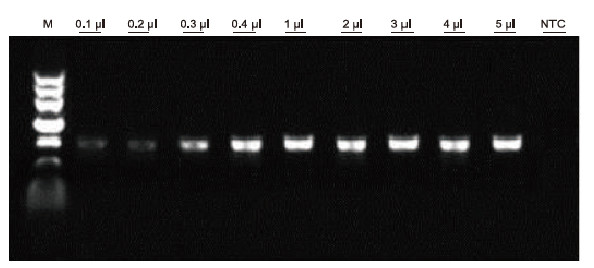 |
Met behulp van menselijke EDTA-anticoagulatie als sjabloon, werd Blood Direct PCR Kit gebruikt voor PCR-detectie van verschillende bloedmonsters. Het PCR-reactiesysteem was 20 l en 1 l bloed werd als sjabloon gebruikt. M: TIANGEN Marker II; 1-9: de laadhoeveelheid bloed is respectievelijk 0,1 l, 0,2 l, 0,3 l, 0,4 l, 1 l, 2 l, 3 l, 4 l en 5 l; NTC: controle zonder sjabloon Experimentele resultaten: Blood Direct PCR Kit is sterk bestand tegen bloed en kan bloedmonsters amplificeren met een laadbereik van 0,1-5 l. |
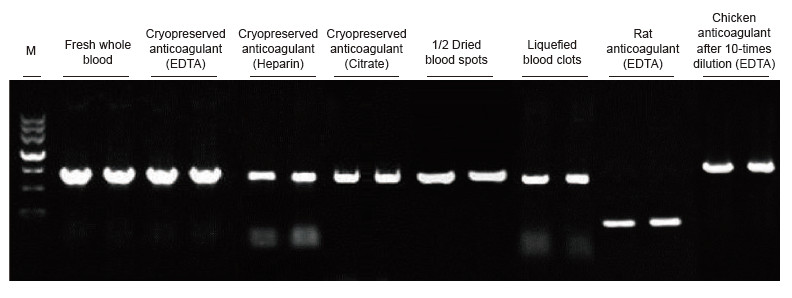 |
Bloedmonsters van mensen, ratten, kippen en andere soorten met verschillende behandelingen werden gebruikt als sjablonen. Blood Direct PCR Kit werd gebruikt om PRNP (humaan, 750 bp), actine (rat, 200 bp) en β-actine (kip, 1,0 kb) te amplificeren. Het PCR-reactiesysteem was 20 l en 1 l bloed werd als sjabloon gebruikt. M: TIANGEN Marker II. Experimentele resultaten: Blood Direct PCR Kit kan worden toegepast op een breed scala aan monsters en de directe PCR-detectie kan worden uitgevoerd op bloedmonsters van verschillende soorten met verschillende behandelingen. |
A-1-sjabloon
■ De template bevat eiwitonzuiverheden of Taq-remmers, enz. ——Zuiver DNA-template, verwijder eiwitonzuiverheden of extraheer template-DNA met zuiveringskits.
■ De denaturatie van de mal is niet volledig ——Verhoog de denaturatietemperatuur op de juiste manier en verleng de denaturatietijd.
■ Sjabloondegradatie ——Maak de sjabloon opnieuw.
A-2 Primer
■ Slechte kwaliteit van primers ——Hersynthetiseer de primer.
■ Degradatie van de primer ——Verdeel de primers met een hoge concentratie in een klein volume voor conservering. Vermijd meerdere keren invriezen en ontdooien of langdurig 4°C gecryopreserveerd.
■ Onjuist ontwerp van primers (bijv. primerlengte niet voldoende, dimeer gevormd tussen primers, enz.) - Herontwerp primers (vermijd vorming van primerdimeer en secundaire structuur)
A-3 Mg2+concentratie
Mg2+ concentratie is te laag ——Verhoog Mg . op de juiste manier2+ concentratie: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
A-4 Onthardingstemperatuur
■ De hoge annealingstemperatuur beïnvloedt de binding van primer en template. ——Verlaag de gloeitemperatuur en optimaliseer de conditie met een gradiënt van 2°C.
A-5 Verlengingstijd
■ Korte verlengingstijd—Verhoog de verlengingstijd.
Fenomenen: Negatieve monsters tonen ook de doelsequentiebanden.
A-1 Contaminatie van PCR
■ Kruisbesmetting van doelsequentie of amplificatieproducten ——Pas het monster met de doelsequentie voorzichtig in het negatieve monster of mors ze niet uit de centrifugebuis. De reagentia of apparatuur moeten worden geautoclaveerd om bestaande nucleïnezuren te verwijderen, en het bestaan van verontreiniging moet worden bepaald door middel van negatieve controle-experimenten.
■ Reagensverontreiniging ——Verdeel de reagentia en bewaar ze bij lage temperatuur.
A-2 Primer
Mg2+ concentratie is te laag ——Verhoog Mg . op de juiste manier2+ concentratie: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
■ Onjuist primerontwerp en de doelsequentie heeft homologie met de niet-doelsequentie. ——Herontwerp inleidingen.
Verschijnselen: De PCR-amplificatiebanden zijn niet consistent met de verwachte grootte, groot of klein, of soms komen zowel specifieke amplificatiebanden als niet-specifieke amplificatiebanden voor.
A-1 Primer
■ Slechte primerspecificiteit
—— Herontwerp de inleiding.
■ De primerconcentratie is te hoog —— Verhoog de denaturatietemperatuur op de juiste manier en verleng de denaturatietijd.
A-2 Mg2+ concentratie
■ De Mg2+ concentratie is te hoog ——Verlaag de Mg2+-concentratie op de juiste manier: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
A-3 Thermostabiele polymerase
■ Overmatige hoeveelheid enzym ——Verminder de hoeveelheid enzym op geschikte wijze met tussenpozen van 0,5 E.
A-4 Onthardingstemperatuur
■ De gloeitemperatuur is te laag — Verhoog de gloeitemperatuur op de juiste manier of gebruik de gloeimethode in twee fasen
A-5 PCR-cycli
■ Te veel PCR-cycli ——Verminder het aantal PCR-cycli.
A-1 Primer——Slechte specificiteit ——Herontwerp de primer, verander de positie en lengte van de primer om de specificiteit te verbeteren; of voer geneste PCR uit.
A-2 Sjabloon-DNA
——De sjabloon is niet zuiver ——Zuiver de sjabloon of extraheer DNA met zuiveringskits.
A-3 Mg2+ concentratie
——Mg2+ concentratie is te hoog ——Mg . op de juiste manier verminderen2+ concentratie: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
A-4 dNTP
——De concentratie van dNTP's is te hoog ——Verlaag de concentratie van dNTP op de juiste manier
A-5 Onthardingstemperatuur
——Te lage gloeitemperatuur ——Verhoog de gloeitemperatuur op gepaste wijze
A-6 Cycli
——Te veel cycli ——Optimaliseer het cyclusnummer

De eerste stap is het kiezen van de juiste polymerase. Regulier Taq-polymerase kan niet proeflezen vanwege een gebrek aan 3'-5'-exonuclease-activiteit, en mismatch zal de verlengingsefficiëntie van fragmenten aanzienlijk verminderen. Daarom kan regulier Taq-polymerase doelfragmenten groter dan 5 kb niet effectief amplificeren. Taq-polymerase met speciale modificatie of andere high-fidelity-polymerase moet worden geselecteerd om de verlengingsefficiëntie te verbeteren en te voldoen aan de behoeften van amplificatie van lange fragmenten. Bovendien vereist de amplificatie van lange fragmenten ook een overeenkomstige aanpassing van het primerontwerp, denaturatietijd, verlengingstijd, buffer-pH, enz. Gewoonlijk kunnen primers met 18-24 bp tot een betere opbrengst leiden. Om schade aan de mal te voorkomen, moet de denaturatietijd bij 94°C worden teruggebracht tot 30 sec of minder per cyclus, en de tijd om de temperatuur te verhogen tot 94°C vóór amplificatie moet minder dan 1 minuut zijn. Bovendien kan het instellen van de verlengingstemperatuur op ongeveer 68°C en het ontwerpen van de verlengingstijd volgens de snelheid van 1 kb/min zorgen voor effectieve amplificatie van lange fragmenten.
Het foutenpercentage van PCR-amplificatie kan worden verminderd door verschillende DNA-polymerasen met hoge betrouwbaarheid te gebruiken. Van alle Taq-DNA-polymerasen die tot nu toe zijn gevonden, heeft het Pfu-enzym het laagste foutenpercentage en de hoogste betrouwbaarheid (zie bijgevoegde tabel). Naast enzymselectie kunnen onderzoekers de PCR-mutatiesnelheid verder verlagen door de reactieomstandigheden te optimaliseren, waaronder het optimaliseren van de buffersamenstelling, de concentratie van thermostabiel polymerase en het optimaliseren van het aantal PCR-cycli.
Producten categorieën
WAAROM VOOR ONS KIEZEN
Sinds de oprichting heeft onze fabriek eersteklas producten ontwikkeld volgens het principe:
van kwaliteit voorop. Onze producten hebben een uitstekende reputatie verworven in de industrie en zijn waardevol bij nieuwe en oude klanten.








