Ultra HiFidelity PCR-kit
Functies
■ Eenvoudig te bedienen: deze kit wordt geleverd als 2× premix en PCR kan worden uitgevoerd door eenvoudig sjablonen en primers toe te voegen.
■ Hoge betrouwbaarheid: de betrouwbaarheid is 50 keer die van Taq-polymerase.
■ Hoge specificiteit: Uitstekende hot-start-prestaties om productspecificiteit te garanderen.
■ Snelle versterking: de verlengingssnelheid kan 10-15 sec/kb bereiken.
■ Sterke uitbreidbaarheid: DNA-fragmenten tot 20 kb kunnen worden geamplificeerd.
■ Brede toepasbaarheid: de kit bevat PCR Enhancer en is geschikt voor de amplificatie van hoge GC en complexe sjablonen.
Specificatie
Type: High-fidelity DNA-polymerase
Versterkingssnelheid: 10-15 sec/kb
Fragmentgrootte: <20kb
Toepassingen: High-fidelity PCR-amplificatie, genklonering, high GC-templateamplificatie, genklonering van complexe genomen, cDNA high-fidelity-amplificatie, SNP-detectie, plaatsspecifieke mutatie, enz.
Opbrengst DNA-extractie van verschillende plantenweefsels:
Opmerking: DNA-opbrengst is afhankelijk van monstertypes. Alle bovenstaande materialen zijn van zachte bladeren.
Alle producten kunnen worden aangepast voor ODM/OEM. Voor details,klik op Aangepaste Service (ODM/OEM)
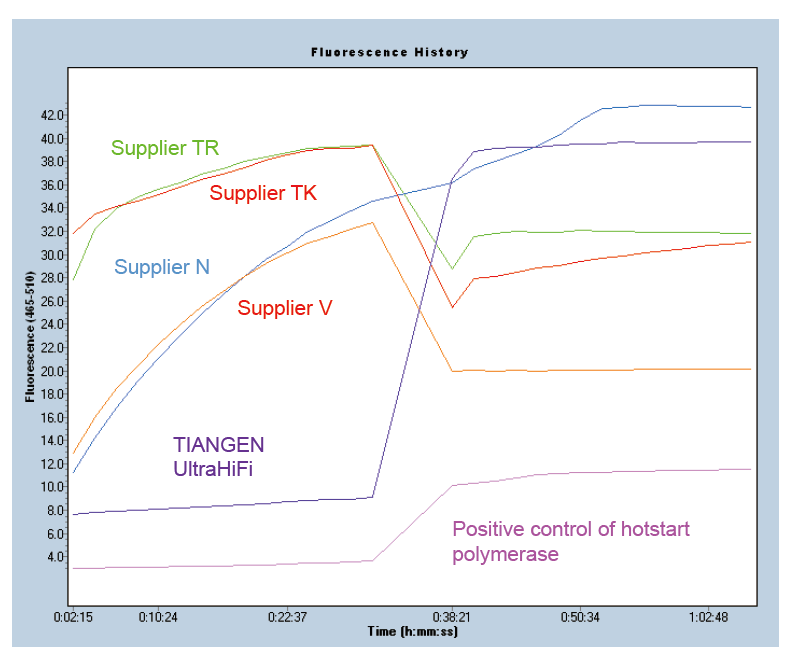 |
Hot-start om productspecificiteit te garanderen Afbeelding 1. Ultra HiFi heeft een uitstekende hotstart-functie om de specificiteit van versterkingsproducten te waarborgen. De methode van moleculaire bakens werd toegepast (Ma et al., Anal Biochem, 2006). |
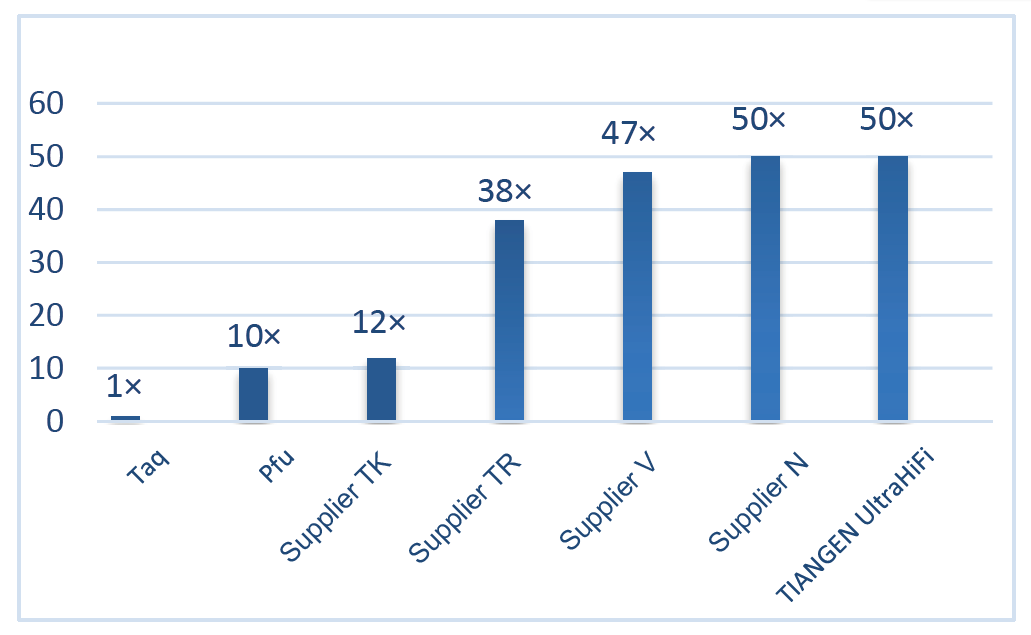 |
Uitstekende high-fidelity, 50 keer hoger dan Taq Polymerase Figuur 2. De betrouwbaarheid van Ultra HiFi is 50 keer hoger dan die van gewone Taq-polymerase. De polymerisatiegetrouwheid van Taq-polymerase (zonder corrigerende activiteit) wordt als referentie gebruikt. |
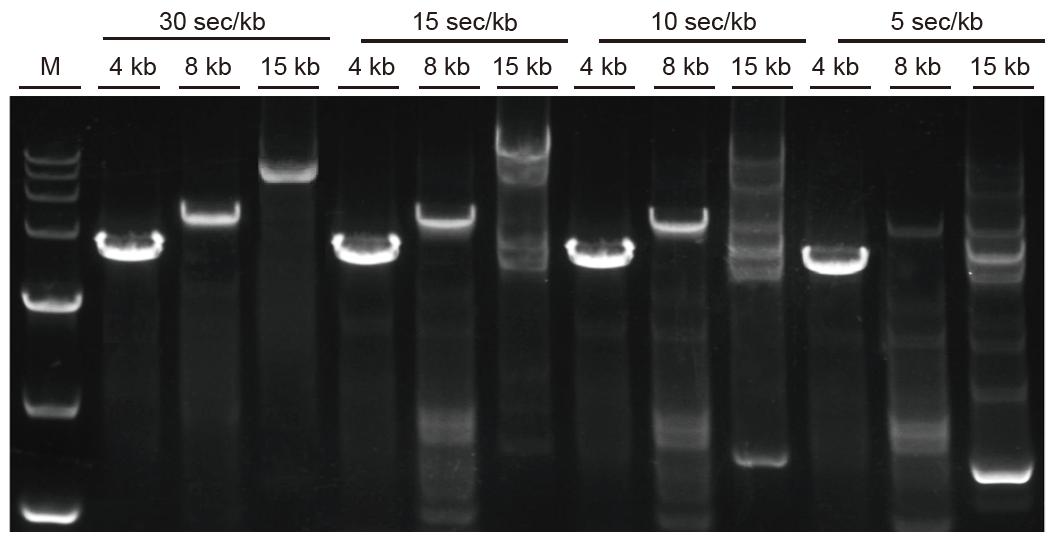 |
Snelle amplificatie en lange fragmenten kunnen snel worden geamplificeerd Fig. 3. Ultra HiFi kan zich uitstrekken tot 5 sec/kb voor fragmenten kleiner dan 4 kb. Voor lange fragmenten kan de amplificatietijd op passende wijze worden verlengd. Voor fragmenten groter dan 15 kb kan de snelheid tot 30 sec/kb bedragen. M: TIANGEN D15000 Marker |
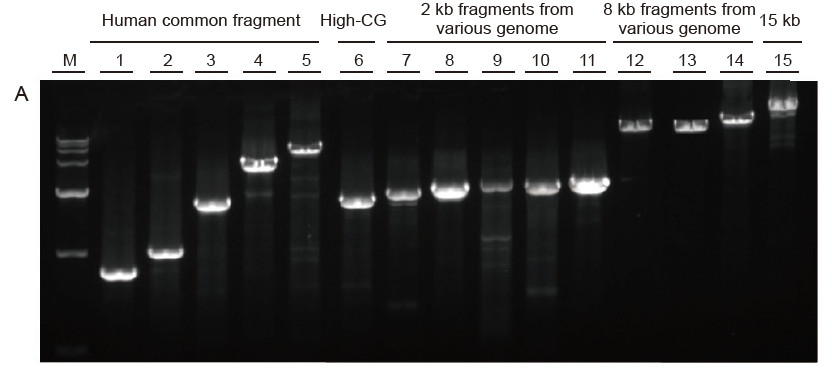 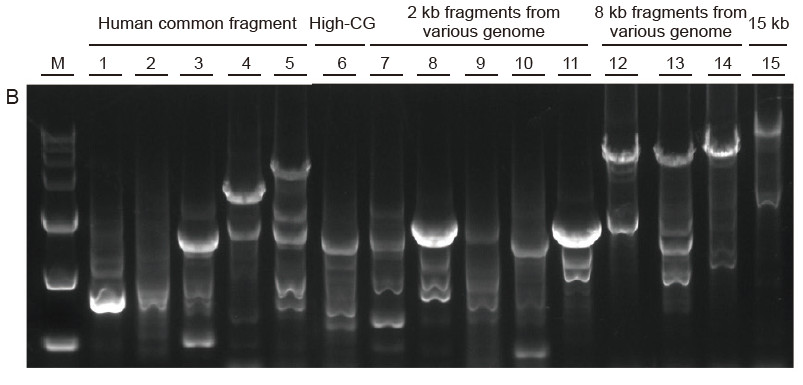 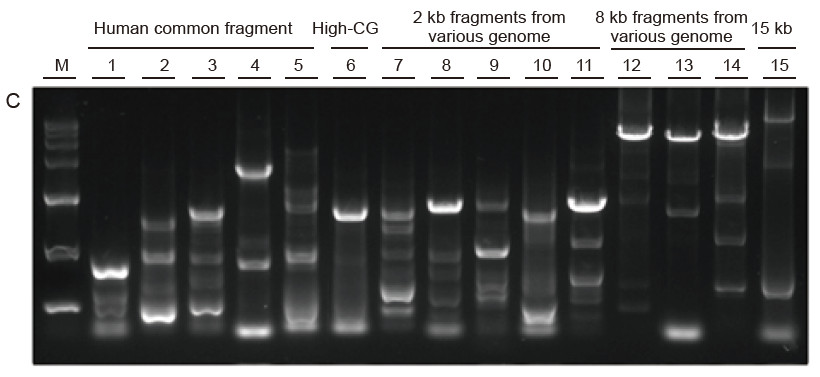 |
Sterke universaliteit en hoge specificiteit, gemakkelijk te lezen hoge GC en lange fragmenten uit verschillende bronnen Afbeelding 4. Ultra HiFi heeft een hoge specificiteit om het succespercentage van de versterking en de producthoeveelheid voor verschillende soorten sjablonen te garanderen. A. Ultra HiFi-versterkingsresultaten B. Hi-Fi-enzymamplificatieresultaten van leverancier K C. Hi-Fi-enzymamplificatieresultaten van leverancier N M: TIANGEN D15000 Marker Baan 1-5. Amplificatieresultaten van sjablonen met verschillende lengtes: 1. 750 bp; 2. 1kb; 3. 2kb; 4. 4kb; 5. 6 kb Baan 6. Amplificatieresultaat van hoge GC-template: 1915 bp (GC%: 70%); Baan 7-11. Amplificatieresultaat van 2 kb-templates van verschillende genoom: 7. Rat; 8. Rijst; 9. Tarwe; 10. Maïs; 11. Bacteriën; Baan 12-14. 8 kb lang fragmentamplificatieresultaat: 12. Rijst; 13. Maïs; |
A-1-sjabloon
■ De template bevat eiwitonzuiverheden of Taq-remmers, enz. ——Zuiver DNA-template, verwijder eiwitonzuiverheden of extraheer template-DNA met zuiveringskits.
■ De denaturatie van de mal is niet volledig ——Verhoog de denaturatietemperatuur op de juiste manier en verleng de denaturatietijd.
■ Sjabloondegradatie ——Maak de sjabloon opnieuw.
A-2 Primer
■ Slechte kwaliteit van primers ——Hersynthetiseer de primer.
■ Degradatie van de primer ——Verdeel de primers met een hoge concentratie in een klein volume voor conservering. Vermijd meerdere keren invriezen en ontdooien of langdurig 4°C gecryopreserveerd.
■ Onjuist ontwerp van primers (bijv. primerlengte niet voldoende, dimeer gevormd tussen primers, enz.) - Herontwerp primers (vermijd vorming van primerdimeer en secundaire structuur)
A-3 Mg2+concentratie
Mg2+ concentratie is te laag ——Verhoog Mg . op de juiste manier2+ concentratie: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
A-4 Onthardingstemperatuur
■ De hoge annealingstemperatuur beïnvloedt de binding van primer en template. ——Verlaag de gloeitemperatuur en optimaliseer de conditie met een gradiënt van 2°C.
A-5 Verlengingstijd
■ Korte verlengingstijd—Verhoog de verlengingstijd.
Fenomenen: Negatieve monsters tonen ook de doelsequentiebanden.
A-1 Contaminatie van PCR
■ Kruisbesmetting van doelsequentie of amplificatieproducten ——Pas het monster met de doelsequentie voorzichtig in het negatieve monster of mors ze niet uit de centrifugebuis. De reagentia of apparatuur moeten worden geautoclaveerd om bestaande nucleïnezuren te verwijderen, en het bestaan van verontreiniging moet worden bepaald door middel van negatieve controle-experimenten.
■ Reagensverontreiniging ——Verdeel de reagentia en bewaar ze bij lage temperatuur.
A-2 Primer
Mg2+ concentratie is te laag ——Verhoog Mg . op de juiste manier2+ concentratie: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
■ Onjuist primerontwerp en de doelsequentie heeft homologie met de niet-doelsequentie. ——Herontwerp inleidingen.
Verschijnselen: De PCR-amplificatiebanden zijn niet consistent met de verwachte grootte, groot of klein, of soms komen zowel specifieke amplificatiebanden als niet-specifieke amplificatiebanden voor.
A-1 Primer
■ Slechte primerspecificiteit
—— Herontwerp de inleiding.
■ De primerconcentratie is te hoog —— Verhoog de denaturatietemperatuur op de juiste manier en verleng de denaturatietijd.
A-2 Mg2+ concentratie
■ De Mg2+ concentratie is te hoog ——Verlaag de Mg2+-concentratie op de juiste manier: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
A-3 Thermostabiele polymerase
■ Overmatige hoeveelheid enzym ——Verminder de hoeveelheid enzym op geschikte wijze met tussenpozen van 0,5 E.
A-4 Onthardingstemperatuur
■ De gloeitemperatuur is te laag — Verhoog de gloeitemperatuur op de juiste manier of gebruik de gloeimethode in twee fasen
A-5 PCR-cycli
■ Te veel PCR-cycli ——Verminder het aantal PCR-cycli.
A-1 Primer——Slechte specificiteit ——Herontwerp de primer, verander de positie en lengte van de primer om de specificiteit te verbeteren; of voer geneste PCR uit.
A-2 Sjabloon-DNA
——De sjabloon is niet zuiver ——Zuiver de sjabloon of extraheer DNA met zuiveringskits.
A-3 Mg2+ concentratie
——Mg2+ concentratie is te hoog ——Mg . op de juiste manier verminderen2+ concentratie: Optimaliseer de Mg2+ concentratie door een reeks reacties van 1 mM tot 3 mM met een interval van 0,5 mM om de optimale Mg . te bepalen2+ concentratie voor elke sjabloon en primer.
A-4 dNTP
——De concentratie van dNTP's is te hoog ——Verlaag de concentratie van dNTP op de juiste manier
A-5 Onthardingstemperatuur
——Te lage gloeitemperatuur ——Verhoog de gloeitemperatuur op gepaste wijze
A-6 Cycli
——Te veel cycli ——Optimaliseer het cyclusnummer

De eerste stap is het kiezen van de juiste polymerase. Regulier Taq-polymerase kan niet proeflezen vanwege een gebrek aan 3'-5'-exonuclease-activiteit, en mismatch zal de verlengingsefficiëntie van fragmenten aanzienlijk verminderen. Daarom kan regulier Taq-polymerase doelfragmenten groter dan 5 kb niet effectief amplificeren. Taq-polymerase met speciale modificatie of andere high-fidelity-polymerase moet worden geselecteerd om de verlengingsefficiëntie te verbeteren en te voldoen aan de behoeften van amplificatie van lange fragmenten. Bovendien vereist de amplificatie van lange fragmenten ook een overeenkomstige aanpassing van het primerontwerp, denaturatietijd, verlengingstijd, buffer-pH, enz. Gewoonlijk kunnen primers met 18-24 bp tot een betere opbrengst leiden. Om schade aan de mal te voorkomen, moet de denaturatietijd bij 94°C worden teruggebracht tot 30 sec of minder per cyclus, en de tijd om de temperatuur te verhogen tot 94°C vóór amplificatie moet minder dan 1 minuut zijn. Bovendien kan het instellen van de verlengingstemperatuur op ongeveer 68°C en het ontwerpen van de verlengingstijd volgens de snelheid van 1 kb/min zorgen voor effectieve amplificatie van lange fragmenten.
Het foutenpercentage van PCR-amplificatie kan worden verminderd door verschillende DNA-polymerasen met hoge betrouwbaarheid te gebruiken. Van alle Taq-DNA-polymerasen die tot nu toe zijn gevonden, heeft het Pfu-enzym het laagste foutenpercentage en de hoogste betrouwbaarheid (zie bijgevoegde tabel). Naast enzymselectie kunnen onderzoekers de PCR-mutatiesnelheid verder verlagen door de reactieomstandigheden te optimaliseren, waaronder het optimaliseren van de buffersamenstelling, de concentratie van thermostabiel polymerase en het optimaliseren van het aantal PCR-cycli.
Producten categorieën
WAAROM VOOR ONS KIEZEN
Sinds de oprichting heeft onze fabriek eersteklas producten ontwikkeld volgens het principe:
van kwaliteit voorop. Onze producten hebben een uitstekende reputatie verworven in de industrie en zijn waardevol bij nieuwe en oude klanten.